为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
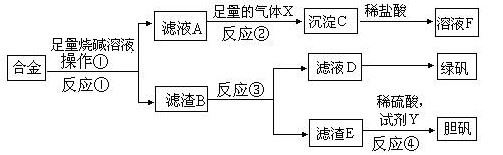
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的化学方程式 ,
反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
碱石灰
(1)FeSO4·7H2O
(2) 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 ↑ ,
CO2 + 2H2O + AlO2- =Al(OH)3+ HCO3-
(3)用试管取少量滤液D,向滤液中滴加KSCN溶液无明显现象,再滴入氯水,若变成血红色,则说明溶液中存在Fe2+。
(4)铜、铁与稀硫酸形成原电池
(5)Cu + H2O2 +H2SO4 = CuSO4 + 2H2O ; 2
(1)绿矾为硫酸亚铁晶体,化学式为:FeSO4·7H2O
(2)反应①为Al与NaOH溶液的反应,离子方程式为:
2Al+2NaOH+2H2O 2NaAlO2+3H2↑;反应②中通入的气体气体X为CO2,CO2、H2O与AlO2-反应生成的沉淀为Al(OH)3,离子方程式为:
2NaAlO2+3H2↑;反应②中通入的气体气体X为CO2,CO2、H2O与AlO2-反应生成的沉淀为Al(OH)3,离子方程式为:
AlO2-+CO2+2H2O Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O
Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-)
2Al(OH)3↓+CO32-)
(3)滤液D的溶质为FeSO4,检验Fe2+的原理为:Fe2+不能使KSCN变为血红色,但加入氧化剂把Fe2+氧化为Fe3+,溶液变为血红色,所以实验方案为:用试管取少量滤液D,向滤液中滴加KSCN(或NaSCN、或NH4SCN)],溶液无明显现象,再滴入氯水(或双氧水,或通入Cl2)若变成血红色,则溶液则中存在Fe2+。
(4)滤渣B中含有铁、铜金属,滴加稀硫酸后,铜、铁与稀硫酸形成了原电池,使反应速率加快。
(5)滤渣E为Cu,加入稀硫酸和试剂Y生成CuSO4,考虑绿色化学工艺,Y为无色液体,则试剂Y为H2O2,则反应④的总化学方程式为:Cu+H2O2+H2SO4 CuSO4+2H2O;Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则化学方程式为:3Cu+2HNO3+3H2SO4
CuSO4+2H2O;Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则化学方程式为:3Cu+2HNO3+3H2SO4 3CuSO4++2NO↑+4H2O,Cu为3mol,则消耗的HNO3为2mol,需该硝酸的体积为:2mol÷1mol•L‾1=2L。
3CuSO4++2NO↑+4H2O,Cu为3mol,则消耗的HNO3为2mol,需该硝酸的体积为:2mol÷1mol•L‾1=2L。
