硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置)。仅用此装置和表中提供的部分物质完成相关实验。
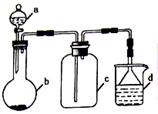
| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
(1)表格中①②③三种物质分别是__________、__________、________(填化学式)。
(2)实验乙中生成气体③的离子反应方程式为________________________;某同学认为将浓硝酸改为稀硝酸,即可以利用本套装置制取NO气体,该同学的设计________(填“正确”或“不正确”)。
(3)已知实验丙中生成氯气的化学方程式为4HCl(浓)+MnO2  MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
____ MnO4-+ ____ H+ + ____ Cl- ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________
(1)SO2;NaOH;NO2 (2)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;不正确
(3)2.0mol;2.0mol;Cl2+2OH-=Cl-+ClO-+H2O;2、16、10、2、5、8H2O
题目分析:(1)浓硫酸与亚硫酸钠反应生成硫酸钠、SO2和水,因此c中收集到的气体是SO2。SO2有毒属于大气污染物,需要尾气处理,则d中盛放的溶液是氢氧化钠,用来吸收SO2,防止污染空气。浓硝酸与铜反应生成硝酸铜、NO2和水,则c中收集的气体是NO2。
(2)浓硝酸与铜反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;由于装置含有空气,能把生成的NO氧化转化为NO2,得不到NO,所以是不正确的。
(3)标准状况下22.4L氯气的物质的量=22.4L÷22.4L/mol=1.0mol,则根据氯原子守恒可知,被氧化的氯化氢的物质的量是1.0mol×2=2.0mol;反应中氯元素的化合价从-1价升高到0价,失去1个电子,所以生成1.0mol氯气转移电子的物质的量是2.0mol。氯气有毒需要尾气处理,与氢氧化钠溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;根据方程式可知,反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。氯元素的化合价从-1价升高到0价,失去1个电子,所以根据电子得失守恒可知氧化剂MnO4-与还原剂Cl-的物质的量之比是1:5。根据原子守恒可知,反应中还有水生成,所以反应的离子方程式为2MnO4-+ 16 H+ + 10 Cl-=2Mn2+ + 5Cl2↑+8H2O。
