有A、B、C、D四种元素,A元素形成的离子中只有一个质子,B原子的最外层电子数是次外层的3倍,C元素的一价阳离子核外有10个电子,D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子.回答下列列问题:
(1)画出D元素的离子结构示意图______;
(2)工业上用电解C和D两元素形成的化合物的水溶液生产D的单质,写出该反应的化学方程式______,电解后的溶液能使酚酞变红的是与电源的______极相连接的区域;
(3)D单质能和A、B、C三元素形成的化合物反应,该反应的化学方程式是______,当有0.1mol的D单质反应时,电子转移______个;
(4)B、C、D三元素能形成一种化合物,1mol该化合物中有36mol电子,该化合物的水溶液是一种______剂,它与A、D两元素形成的化合物的水溶液反应时能产生一种有毒气体,该反应的化学方程式是______.
有A、B、C、D四种元素,A元素形成的离子中只有一个质子,则A是H元素,B原子的最外层电子数是次外层的3倍,则B元素是O元素,C元素的一价阳离子核外有10个电子,则C是Na元素,D元素的原子得到一个电子后能形成与氩原子电子层结构相同的离子,则D是Cl元素,
(1)氯离子核外有3个电子层,最外层有8个电子,所以其离子结构示意图为: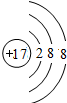 ,故答案为:
,故答案为: ;
;
(2)电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解方程式为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,阴极上氢离子放电,同时阴极附近有氢氧根离子生成,所以溶液呈碱性,酚酞遇碱变红色,阴极与电源负极相连电解 .
故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;负极;电解 .
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,当有0.1mol氯气反应时,转移电子的个数=0.1mol×(1-0)NA=0.1NA,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;0.1NA;
(4)B、C、D三元素能形成一种化合物,1mol该化合物中有36mol电子,该化合物是次氯酸钠,次氯酸钠具有强氧化性能杀菌消毒,所以次氯酸钠的水溶液是一种 消毒剂,次氯酸钠具有强氧化性,盐酸具有还原性,所以二者能发生氧化还原反应生成氯气,反应方程式为:NaClO+2HCl=NaCl+Cl2↑+H2O,
故答案为:消毒;NaClO+2HCl=NaCl+Cl2+H2O.
