碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 。
(2)据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 。
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。
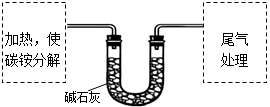
(1)碳铵固体应放在 中进行加热。
A.试管
B.蒸发皿
C.烧瓶
D.坩埚(2)从安全的角度考虑,尾气处理的装置可以选用 。
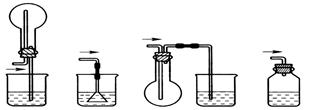
A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是 g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理。 (填“合理”“不合理”),理由是 。
【定性实验】(1)HCO3-、CO32- (各1分,共2分)
(2)NH4++OH-=NH3↑+H2O; HCO3-+OH-=CO32-+H2O
(或NH4++HCO3-+2OH-=NH3+CO32-+2H2O) (2分)
【定量实验】(1)A (2分)(2)A (2分) (3)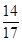 (a-b) (2分)
(a-b) (2分)
(4)本小题属于开放性试题,若考生回答“合理”或“不合理”且理由能做出相应解释,可酌情给分(3分)。例如:考生回答
①不合理,因为碳铵中可能含有HCO3-,不能与BaCl2产生沉淀,所测得碳元素质量分数不准确。
②合理,因为碳铵中只含有CO32-,加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。
③不合理;测得的结果不准确。
题目分析:【定性实验】(1)取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,这说明该气体应该是二氧化碳,所以碳铵中所含有阴离子可能是HCO3-、CO32-。
(2)另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,这说明该气体是氨气,所以碳铵与足量NaOH溶液加热反应的离子方程式可能是NH4++OH-=NH3↑+H2O;HCO3-+OH-=CO32-+H2O或NH4++HCO3-+2OH-=NH3+CO32-+2H2O。
【定量实验】(1)固体灼烧应该放在坩埚或试管中进行,由于需要测量生成的气体,因此应该放在试管中,答案选A。
(2)尾气主要是氨气,氨气极易溶于水,直接通入中水中吸收容易引起液体倒吸,选项BC容易倒吸,D不符合吸收要求,所以答案选A。
(3)碱石灰吸收的是水和二氧化碳,U形管增加的质量就是水和二氧化碳的质量,则根据原子守恒可知,固体灼烧放出氨气的质量是(a-b)g,所以根据氮原子守恒可知N元素的质量是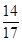 (a-b)。
(a-b)。
(4)能和氯化钡反应的是碳酸盐,因此如果该物质中含有碳酸氢铵,则是不合理的。因为HCO3-不能与BaCl2产生沉淀,所测得碳元素质量分数不准确;但如果该物质中只有碳酸铵则是合理的,因为加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。
