(2014届山东省泰安市高三第一轮复习质量检测化学试卷)
碘化钠是制备无机和有机碘化物的原料,在医药上用作祛痰剂和利尿剂等。工业上用铁屑还原法制备NaI,其主要流程如下图:

(1)写出铁屑转化为Fe(OH)3反应的离子方程式: 。
(2)判断碘已完全反应的方法是 。
(3)由滤液得到NaI晶体的操作是 。
(4)测定产品中NaI含量的方法是:
a.称取3.000g样品溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.100mol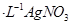 溶液滴定至终点,消耗
溶液滴定至终点,消耗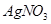 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有 ,
其中使用前需进行润洗的仪器是 ;
②上述样品中NaI的质量分数为 。
(1)2Fe+IO3‾+3H2O=2Fe(OH)3↓+I‾(2分)
(2)用小试管取溶液少许,向其中滴加几滴淀粉溶液,如果溶液不变蓝色,则证明碘反应完全(2分)
(3)蒸发、结晶(1分)
(4)①250mL容量瓶、滴定管(1分)滴定管(1分) ②95%
(1)根据流程图可以看出,NaOH与I2共热反应可生成NaI和NaIO3,加入铁屑生成了Fe(OH)3和NaI,所以铁屑转化为Fe(OH)3反应的离子方程式为:2Fe+IO3‾+3H2O=2Fe(OH)3↓+I‾
(2)利用I2能使淀粉变蓝的现象判断碘是否反应完全:用小试管取溶液少许,向其中滴加几滴淀粉溶液,如果溶液不变蓝色,则证明碘反应完全。
(3)NaI溶液在蒸发水时,没有副反应发生,所以采用蒸发、结晶的方法得到NaI晶体。
(4)①250mL容量瓶、滴定管需要检查是否漏液,滴定管在使用前需要进行润洗。
②根据AgNO3的物质的量求算NaI的物质的量,所以样品中NaI的质量分数为:0.100mol/L×0.019L×150g/mol×10÷3.000g×100%=95%

 力首先传递至何处()。
力首先传递至何处()。