(11分)“对比实验”是化学学习中行之有效的思维方法。某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题。
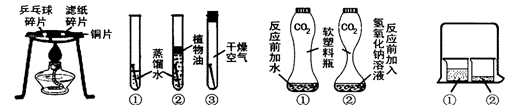
A B C D
A.燃烧的条件
B.铁钉生锈的条件
C.证明CO2与NaOH反应
D.分子运动的现象(1)通过实验A,可以说明燃烧的条件之一是 ,实验中使用铜片,是利用了铜的 性(填一条物理性质)
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与 直接接触。欲除去铁锈可用 洗的方法。
(3)实验C是根据塑料瓶变瘪的程度证明CO2与NaOH溶液中的溶质确实发生了反应,(瓶①)的作用是 ,这一反应的化学方程式为 。
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的。当烧杯①中液体是浓盐酸,烧杯②中液体是滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是 。其中盐酸与NaOH反应的化学方程式为 ,属于 反应(填反应类型)
(1)达到燃烧所需的最低温度(或达到着火点) 导热
(2)氧气(或空气)和水 稀盐酸(或稀硫酸)
(3)对比,证明不是因为二氧化碳溶于水是瓶变瘪;CO2 + 2NaOH =Na2CO3 + H2O
(4) 红色逐渐变成无色 NaOH + HCl=NaCl + H2O 复分解反应
题目分析:(1)因为二者都是可燃物且与氧气接触,故通过实验A,可以说明燃烧的条件之一是达到燃烧所需的最低温度(或达到着火点)实验中使用铜片,是利用了铜的导热性;(2)铁生锈的主要条件是铁与 氧气(或空气)和水,直接接触。欲除去铁锈根据铁锈的成分主要是氧化铁的性质,故可用稀盐酸或稀硫酸洗的方法。(3)实验C是根据塑料瓶变瘪的程度证明CO2与NaOH溶液中的溶质确实发生了反应,(瓶①)的作用是对比 ,反应的化学方程式为CO2 + 2NaOH =Na2CO3 + H2O ;(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的。当烧杯①中液体是浓盐酸,烧杯②中液体是滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐变成无色,盐酸与NaOH反应的化学方程式为NaOH + HCl=NaCl + H2O ,反应的类型为复分解反应
