溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
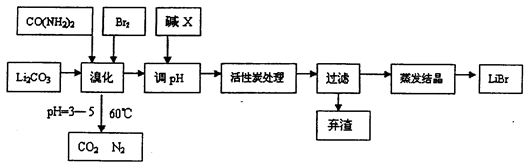
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
(1)二氧化碳 (1分)逆反应方向(1分) 温度过高会加快溴蒸汽的挥发或次溴酸根会发生自身氧化还原反应(2分)
(2)3BrO- BrO3- +2 Br- (2分)
BrO3- +2 Br- (2分)
(3)LiOH (1分)吸附脱色(1分)
(4)3 Br2+3 Li2CO3+2 NH3.H2O="6" LiBr+5 H2O+N2↑+3 CO2↑ (3分)
(5)2 CO32-- 4 e-=O2↑+2CO2↑ (2分)
(6)不能,因为在图示流程中加入的 LiOH也会生成LiBr (2分)
题目分析:(1)溴化时,pH过小,酸性大,碳酸锂会反应生成CO2,另一方面使溴单质和水的反应Br2+H2O H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
H++Br-+HBrO平衡向逆反应方向移动;温度过高会加快溴蒸汽的挥发和次溴酸根会发生自身氧化还原反应,所以温度不宜超过60℃。
(2) BrO-发生了自身的氧化还原反应是Br元素化合价升高和降低:3BrO- BrO3- +2 Br-。
BrO3- +2 Br-。
(3)调节pH溶液时不增加新杂质,阳离子是Li+,故碱是LiOH;活性炭用于吸附脱色。
(4)题干信息“氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气”,不难写出3 Br2+3 Li2CO3+2 NH3.H2O="6" LiBr+5 H2O+N2↑+3 CO2↑。
(5) 用惰性电极电解熔融碳酸锂可得到金属锂,阳极阴离子CO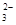 放电,电极方程式为2 CO
放电,电极方程式为2 CO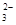 -4 e-=O2↑+2CO2↑。
-4 e-=O2↑+2CO2↑。
(6) 若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,因为在图示流程中加入的 LiOH也会生成LiBr,据此不能计算出溴化锂的产率。
