(15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
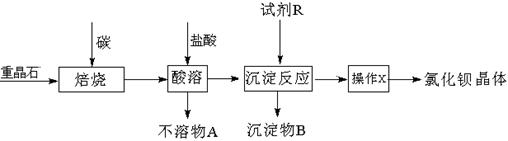
(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是 (填字母编号)。
a.用澄清石灰水吸收气体 b.用浓硫酸吸收气体 c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是 (写两个)。
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于 (填仪器名称)中冷却;④ ;⑤恒重操作。恒重操作的目的是 ;若最终测出的n值偏大,可能的实验操作误差原因是 (举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验: (用装置代号以“A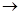
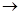 ……
……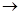 ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)

(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO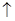 +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
(1)c (2)3C+2Fe2O3高温4Fe+3CO2↑、2C+SiO2高温Si+2CO↑
(3)干燥器;称量冷却后的氯化钡样品质量(或称量);保证氯化钡晶体脱水完全;加热前称量样品质量偏大(或最后称量样品质量偏小,或灼烧、转移样品时有样品损失等)
(4)A→C→D或A→D→C
(5)
题目分析:(1)根据已知信息可知硫酸钡与碳在高温下反应生成CO气体,CO与石灰水和浓硫酸等均不反应,但可以燃烧,因此回收处理所产生的气体,恰当的方法是点燃气体,答案选c。
(2)由于矿石中还含有氧化铁和二氧化硅,而在高温下二者均能与碳反应,反应的化学方程式分别为3C+2Fe2O3高温4Fe+3CO2↑、2C+SiO2高温Si+2CO↑。
(3)为防止吸收水蒸气,冷却应该在干燥器中完成;冷却后需要进行的操作是称量;为了保证氯化钡晶体脱水完全,需要恒重操作;若最终测出的n值偏大,可能的实验操作误差原因有加热前称量样品质量偏大或最后称量样品质量偏小,或灼烧、转移样品时有样品损失等。
(4)只需要测量出生成的水蒸气质量即可,而浓硫酸或碱石灰均可以吸收水蒸气,另外为了防止空气中的水蒸气影响,还需要防止空气中的水蒸气进入,因此正确的连接顺序是A→C→D或A→D→C。
(5)由于煅烧产生的硫化钡不溶于水,易溶于盐酸,因此将煅烧后的混合物溶解在水中过滤即得到氯化钡溶液,然后通过蒸发浓缩、冷却结晶即得到氯化钡晶体,最后过滤、洗涤、干燥、称量即可。
