(本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。
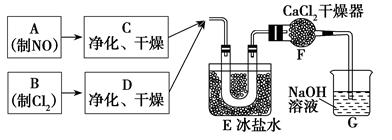
34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。
34. KClO3(固体)+6HCl(浓)→KCl+3Cl2↑+3H2O (2分)
35. 防止G中水蒸气进入U形管,避免引起NOCl水解。(2分)
36. 2NOCl+H2O → N2O3+2HCl (或2NOCl+H2O → NO+NO2+2HCl) (2分)
37. 防止NO被装置中的氧气氧化为NO2;(1分)保持Cl2过量,使NO完全转化,避免
NO逸出污染空气(3分)
题目分析:34.氯元素的归中反应;35. NOCl易与水反应,装置F可以防止尾气吸收装置G的水蒸气进入;36. NOCl中氮元素化合价为+3价,水解化合价不变,生成N2O3(或1:1的NO和NO2);37.装置中空气中氧气与NO反应生成NO2,进而产生杂质硝酰氯;反应中过量的Cl2,使NO完全转化,避免
NO逸出污染空气。
