(15分)用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:
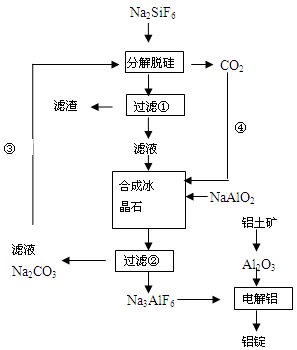
(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________ 。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用 。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少?
(1)三 Al2O3+2NaOH=2NaAlO2+H2O
(2)NaF SiO2
(3)2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF 6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3
(4)Na2CO3和CO2循环使用 理论正好,因有损耗均需补充
(5)88.7%
题目分析:(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程,首先加足量的NaOH溶液,使Al转化为AlO2-,再向该溶液中加足量的硝酸或硫酸,这时Al变为Al3+.然后加入足量的氨水得到Al(OH)3沉淀,将其过滤出来,洗涤干净并烘干。最后灼烧Al(OH)3得到纯净的Al2O3。因此需要三个环节。第一步反应的方程式Al2O3+2NaOH=2NaAlO2+H2O。(2)该制备工艺中有两次过滤操作,有流程图可知:在过滤操作①的滤液是NaF;滤渣是SiO2;(3)分解脱硅化学反应方程式是2Na2CO3+Na2SiF6=SiO2↓+2CO2↑+ 6NaF;合成冰晶石化学反应方程式分别为:6NaF +NaAlO2+2CO2=Na3AlF6↓+2Na2CO3 ;(4)工艺过程中③和④的目的是Na2CO3和CO2循环使用,提高物质的利用率、节能、环保。由第三步的方程式可知在理论上碳酸钠和二氧化碳恰好完全反应。而在实际应用使由于物质的利用率不可能100%,所以均需补充。(5)一天制Al 1.430 t,n(e-)=1.430×106g÷27g/mol×3=1.6×105mol.电量Q=1.6×105×6.02×1023×1.6×10-19=1.54×1010,消耗的电能n(e-)=2×105×3600×24=1.73×1010,所以电解效率是(1.54×1010÷1.73×1010)×100%=88.7%.
