某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式______;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.你认为他能否达到目的?______(填“能”或“否”),理由是______
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
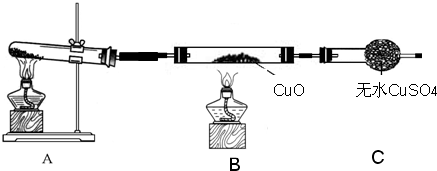
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是______
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.写出氨气与CuO反应的化学方程式______.
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O______.
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A.冷却后称量,A的质量为72g.据此可推得,A的化学式为______.由此,得到的结论是______.
(一)(1)实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O, △ .
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O; △ .
(2)氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(二)(3)氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;
(4)CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为
3CuO+2NH3
3Cu+N2+3H2O, △ .
故答案为:3CuO+2NH3
3Cu+N2+3H2O; △ .
(三)(5)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(6)取98g Cu(OH)2固体,即n( Cu(OH)2)=1mol,加热至80℃~100℃时,得到黑色固体粉末,该黑色粉末为CuO,继续加热到1000℃以上,黑色粉末全部变为红色粉末A,则A为Cu2O,根据反应2Cu(OH)2
Cu2O+2H2O计算可得m(Cu2O)=n(Cu2O)×M(Cu2O)=0.5mol×144g/mol=72g,说明红色粉末为Cu2O,且Cu2O比CuO稳定, 高温 .
故答案为:Cu2O;CuO比Cu2O的热稳定性差.
