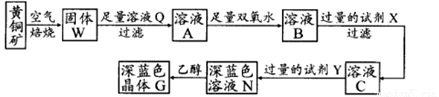
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
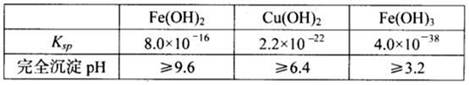
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式 ;
(2)试剂X的化学式为 ,双氧水的作用是 ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH值的方法是 ;
(4)在溶液N中加入乙醇的目的是 。
(1)2CuFeS2+O2 Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
(2)CuO或合理答案;将Fe2+氧化为Fe3+
(3)10-5;用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色
(4)降低晶体溶解度,有利于晶体析出
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,即Cu2S和2FeS,由S元素守恒,S元素有多余,与O2结合为SO2。
(2)含中含有氧Fe2+,加入双氧水的目的就是把Fe2+氧化为Fe3+,B溶液含Cu2+和Fe3+,为了除去Fe3+,可以降低溶液的pH至3.2到6.4之间,试剂X的化学式为CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等;
(3)试剂Y是氨水,0.1 mol/L时pH=11,c(OH-)≈c(NH4+)=10-3;NH3·H2O的电离常数为K=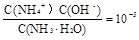 ;
;
(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
