(15分)硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①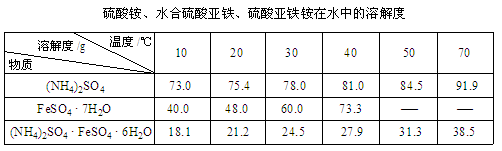
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方法为: 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。
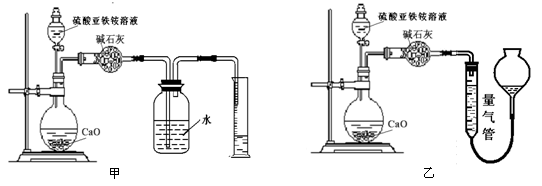
(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
(15分)
I.(1)水浴加热(1分 )
防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出(2分)
(2)加热蒸发,浓缩结晶(2分)
(3) b(1分 )
II.(1) Fe2+已被空气部分氧化 (2分)
取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已
被空气部分氧化 (2分)
(2)①乙(1分) 甲装置会出现倒吸(1分) c (1分)
②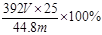 (2分)
(2分)
题目分析:I.(1)步骤2中的温度控制在70-75℃,所以选择水浴加热;Fe2+易被氧气氧化,而且温度降低硫酸亚铁的溶解度减小,所以必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+易被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(2)从硫酸亚铁铵滤液到晶体,中间需要经过加热蒸发,浓缩结晶;
(3)因为莫尔盐在乙醇溶剂中难溶,所以选择用乙醇洗涤,答案选b;
II.(1)用酸性高锰酸钾溶液滴定,原理是亚铁离子被酸性高锰酸钾溶液氧化,利用所用溶液的体积计算亚铁离子的量,从而计算晶体的纯度;用氯化钡溶液滴定,原理是硫酸根离子与钡离子反应生成硫酸钡沉淀,利用沉淀的质量计算硫酸根离子的量,从而计算晶体的纯度。硫酸根离子不会发生变化,所以方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化;验证推测的方法即是验证溶液中是否存在铁离子,具体操作是取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(2)①装置乙比较合理,因为甲装置会出现倒吸,无法测量生成气体的质量;选择乙装置,则量气管中盛放的试剂是四氯化碳,因为氨气易溶于水,不溶于四氯化碳,测量数据比较准确,所以答案选c;
②根据硫酸亚铁铵的化学式得出2NH3~(NH4)2SO4•FeSO4•6H2O,所以500mL溶液中硫酸亚铁铵晶体的质量为VL/22.4L/mol/2×392g/mol×25,其纯度为VL/22.4L/mol/2×392g/mol×25/mg×100%=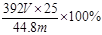 。
。
