化学实验是化学学习与研究的基础.
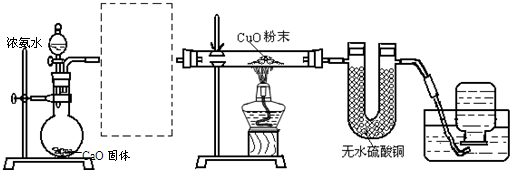
(1)某同学用下列装置(部分未画出)研究氨气与氧化铜的反应.
实验现象记录如下:黑色氧化铜粉末变为光亮红色;无水硫酸铜粉末变蓝色;集气瓶中收集到一种无色气体(进一步实验证明:该气体化学性质稳定).
①虚线框内所缺为干燥装置,采用的干燥剂为______.
②写出下列反应的化学方程式:
浓氨水与CaO固体反应:______.氨气与氧化铜反应:______.
(2)下列实验过程中涉及到的反应物与生成物有:Cl2、KI、KCl、I2、HCl、H2O和一种未知物质X.
[实验]第一步:向盛有KI溶液、CCl4的试管中滴加氯水,CCl4层变成紫色.
第二步:继续向试管中滴加氯水,振荡,CCl4层逐渐变浅,最后呈无色.
①第一步反应中的氧化剂为______.
②若第二步反应中,1mol I2被氧化失去10mol电子,则未知物X的化学式为______.
(1)左边产生的气体是碱性气体氨气,应用碱石灰干燥,①,故答案为:碱石灰;
②浓氨水与CaO固体反应生成氢氧化钙和氨气;氨气与氧化铜反应生成铜,氮气和水,故答案为:NH3?H2O+CaO=Ca(OH)2+NH3↑;2NH3+3CuO
3Cu+N2+3H2O; △ .
(2)①氯气有强氧化性,可将碘化钾氧化为碘单质,故答案为:Cl2;
②1molI2被氧化失去10mol电子,那么一个碘原子失去5个电子,化合价为+5价,反应方程式为:5Cl2+I2+6H2O═2HIO3+10HCl,故答案为:HIO3;
