化学一一选修物质结构与性质
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子核外部分电子排布式为:NsnNpn;B原子核外2P轨道有3个未成对电子:C原子核外S能级电子总数和P能级电子总数相同,且P能级成对电子数等于未成对电子数:D原子核外M层全充满,N层只有1个电子.
请回答:
(1)B元素外围电子排布图为:______.
(2)A、B、C的第一电离能由大到小顺序为______,电负性由大到小顺序为______(用元素符号回答).
(3)B和C两元素形成的阴离子BC-3中B的杂化类型为______,空间构型为______.
(4)与BC-3互为等电子体且含有A、C两元素的微粒是______.(写化学式)
(5)比较A、B的氢化物在水中溶解度大小并说明原因______.
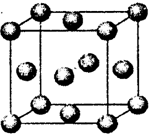
(6)D元素基态原子电子排布______,该元素单质形成的晶体晶胞如图所示,则D元素单质的堆积方式为______,已知D原子半径为r,相对原子质量为Mr,则D元素单质的密度可表示为______.(用NA表示阿伏加德罗常数)
A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.B原子核外2P轨道有3个未成对电子,B原子的核外电子排布式为1s22s22p3,故B为氮元素;A原子核外部分电子排布式为:NsnNpn,s能级只能容纳2个电子,所以为Ns2Np2,A原子序数小于氮元素,A为碳元素;C原子核外S能级电子总数和P能级电子总数相同,则C原子电子层数不大于3,C原子序数大于氮元素,P能级成对电子数等于未成对电子数,则p能级有4个电子,只有一种p能级,即C有2个电子层,核外电子排布式为1s22s22p4,故C为氧元素;D原子核外M层全充满,N层只有1个电子,D原子序数为29,故D为铜元素.
故A为碳元素、B为氮元素、C为氧元素、D为铜元素.
(1)B为氮元素,原子的核外电子排布式为1s22s22p3,所以外围电子排布图为2s22p3.
故答案为:2s22p3.
(2)A为碳元素、B为氮元素、C为氧元素,同周期自左而右,第一电离能呈增大趋势,但氮元素的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能,所以第一电离能N>O>C;同周期自左而右,电负性增大,所以电负性O>N>C.
故答案为:N>O>C;O>N>C.
(3)B为氮元素、C为氧元素,B和C两元素形成的阴离子BC-3为NO-3,N原子杂化轨道数为
=3,采取sp2杂化,D原子最外层电子数全部参与成键,为平面三角形.5+1 2
故答案为:sp2;平面三角形.
(4)A为碳元素、B为氮元素、C为氧元素,BC-3为NO3-,与NO3-互为等电子体且含有C、O两元素的微粒是CO32-.
故答案为:CO32-.
(5)NH3是极性分子,且NH3与水分子形成氢键更易发生化学反应;CH4是非极性分子,根据相似相溶原理可知溶解性NH3>CH4.
故答案为:溶解性:NH3>CH4,因为NH3是极性分子,且NH3与水分子形成氢键更易发生化学反应;CH4是非极性分子,根据相似相溶原理可知溶解性NH3>CH4.
(6)D为铜元素,元素基态原子电子排布为1s22s22p63s23p63d104s1;由单质形成的晶体晶胞图可知,晶体为面方立方最密堆积;
D原子半径为r,令晶胞的棱长为x,则2x2=(4r)2,所以x=2
r,所以晶胞的体积V=(22
r)3=162
r3.晶胞中含有的铜原子数目为8×2
+6×1 8
=4,所以晶胞的质量为4×1 2
g,所以晶体的密度为Mr NA
=4× Mr NA 16
r32
.Mr 4
r32
故答案为:1s22s22p63s23p63d104s1;面方立方最密堆积;
.Mr 4
r32
