氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。
(1)工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示)_____________________。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
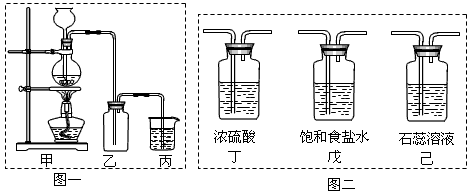
指出图一装置中的错误之处_____________、____________,
(2)丙装置的作用_____________。丙装置中发生反应的离子方程式______________________。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序:_____________。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是_____________。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?_____________。为什么?__________________________。
(1)反应原理为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;未用石棉网;用长颈漏斗而未用分液漏斗
2NaOH+H2↑+Cl2↑;未用石棉网;用长颈漏斗而未用分液漏斗
(2)吸收多余氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O
(3)甲 戊 丁 乙 丙
(4)AC
(5)不对;使石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2