某同学用如下实验装置及化学药品制取氨气并研究氨气的催化氧化.
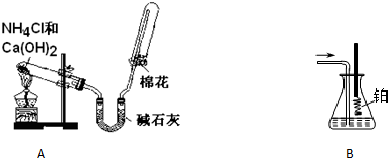
请你按要求回答下列问题:
(1)该同学制取氨气的化学方程式为______.
(2)检验氨气是否收集满的方法是(简述操作方法、现象和结论)______.
(3)一段时间后,将收集氨气的试管倒立在水槽中,观察到试管内液面最终只上升到试管的一半.若不考虑试管内溶质扩散到水槽中,则标准状况下,试管内溶液的物质的量浓度为______.
(4)用B装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入B装置的锥形瓶内,写出锥形瓶内氨氧化的化学方程式______.
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、______、______离子.
(1)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2 △ .
CaCl2+2NH3↑+2H2O; △ .
(2)氨气能使湿润的红色石蕊试纸变蓝,所以可以用湿润的红色石蕊试纸检验,检验方法是:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满),
故答案为:将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
(3)C=
=n V
=
V1 2 Vm
V1 2
=1 Vm
mol/L=0.045mol/L,故答案为:0.045mol/L; 1 22.4
(4)加热、铂丝作催化剂条件下,氨气被氧化生成一氧化氮和水,反应方程式为:4NH3十5O2
4NO+6H2O,故答案为:4NH3十5O2催化剂 . △
4NO+6H2O; 催化剂 . △
(5)溶液中的溶质是氨水和硝酸铵,溶剂是水,氨水电离出铵根离子和氢氧根离子,硝酸铵电离出铵根离子和硝酸根离子,水电离出氢离子和氢氧根离子,所以溶液中还存在离子NH4+ NO3-,
故答案为:NH4+ NO3-.
