实验室制取氯气的装置如图1:
(1)装置F的名称是______;按图组装好装置后首先要进行的操作是:______.
(2)装置B中盛放的试剂是______,其作用是______;装置C中盛放的试剂是______,其作用是______.
(3)写出E中发生反应的化学方程式:______.
(4)图2装置是洗气瓶,该装置在化学实验中除洗气外,还有多种用途,试再写出其一种用途:______.
(5)实验室有时用高锰酸钾代替二氧化锰,与浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若15.8g KMnO4与足量的浓盐酸充分反应,则有______mol HCl被氧化,转移电子的物质的量为______mol,产生的Cl2在标准状况下的体积为______L.
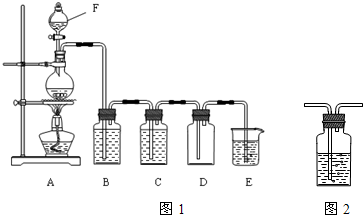
(1)装置F的名称是分液漏斗,制备气体组装好装置后首先要进行的操作是检查装置的气密性,
故答案为:分液漏斗,检查装置的气密性;
(2)装置B盛放饱和食盐水,除去HCl气体;装置C中盛放浓硫酸,吸收水蒸气,
故答案为:饱和食盐水,除去HCl气体;浓硫酸,吸收水蒸气;
(3)装置E盛放氢氧化钠溶液,吸收尾气中的氯气,反应方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(4)图2装置可以做安全瓶,量气瓶等,
故答案为:安全瓶、量气瓶;
(5)15.8g KMnO4的物质的量为
=0.1mol,由2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O可知生成的氯气的物质的量为0.1mol×15.8g 158g/mol
=0.25mol,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化的HCl为0.25mol×2=0.5mol,氯元素化合价由-1价升高为0计算,故转移电子物质的量为0.25mol×2=0.5mol,生成氯气的体积为0.25mol×22.4L/mol=5.6L,5 2
故答案为:0.5,0.5,5.6.
