某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质. △ .

试回答下列问题:
(1)每生成1mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数).
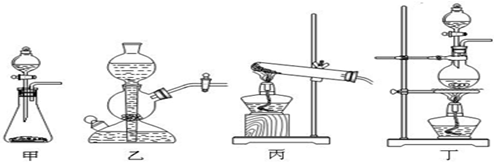
(2)该实验中A处可选用装置______(填写甲.乙.丙或丁).
(3)检查A装置的气密性的方法是用弹簧夹夹住______处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中______ 时,表明该装置不漏气.
(4)装置B中发生反应的离子方程式为______.
(5)装置C中发生反应的离子方程式为______
(6)装置E中的试剂是______(任填一种合适试剂的名称),其作用是______
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)______.
(1)Ca(C1O)2+CaCl2+H2SO 4
2CaSO4+2Cl2↑+2H2O 转移电子 △ .
2 mol 2 NA
1mol NA
故答案为:NA
(2)反应物的状态为固体和液体,反应条件是加热.
故选丁.
(3)夹住橡皮管,向分液漏斗中加水并打开活塞,如果漏气,分液漏斗内压强减小,水面会下降,否则不含下降.
故答案为:a,液面(水面)不下降.
(4)漏气有氧化性,能置换出碘单质,
故答案为:Cl2+2I-=I2+2Cl-
(5)氯气有氧化性,亚硫酸钠有还原性,氯气和亚硫酸钠能发生氧化还原反应,生成硫酸钠和盐酸.
故答案为:Cl2+SO32-+H2O=SO42-+2H++2Cl-
(6)氯气有毒,不能直接排空,因为氯气和水反应生成盐酸和次氯酸,酸能和碱反应,从而达到吸收氯气的作用.故答案为:氢氧化钠溶液或碳酸钠溶液; 吸收多余的氯气,防止污染空气.
(7)三价铁离子和硫氰化钾反应,使溶液变成血红色.
故答案为:取装置D中的溶液于一支洁净试管中,滴加适量的KSCN溶液,溶液变成血红色,则证明有FeCl3生成.
