在工业上,氯气是一种重要的化工原料;在实验室中,氯气和氯水是重要的化学试剂。
(1)资料显示,漂白粉在酸性(如硫酸)条件下可发生反应并生成氯气,有关反应的化学方程式为 Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
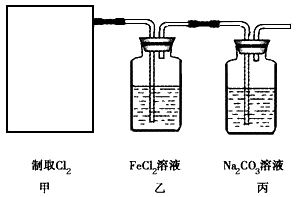
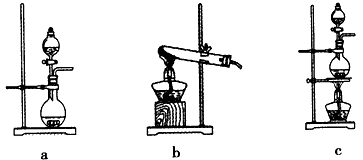
①在该实验中,甲部分的装置是__(填字母序号)。
②证明乙装置中FeCl2与Cl2发生了氧化还原反应的方法是___。
③丙装置中通入少量的Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强 于次氯酸,则丙中发生反应的化学方程式是___。
④该实验存在一个明显的缺陷,改进的方法是___
(2)某同学设计了一个实验方案以证明新制氯水中含有次氯酸。他所用的试剂如下:新制氯水、 0.5 mol.L-1的CaCl2溶液、品红溶液、CaCO3粉末,请你协助他完成实验方案。
步骤一:取5 mL 0.5 mol.L-1的CaCl2溶液于试管中,滴入3滴品红溶液,振荡,溶液不褪色。
步骤二:取5 mL新制氯水于试管中,___。
步骤三:____。 说明新制氯水中存在次氯酸的实验现象是___。设计步骤一的理由是___。
(1)①c;
②取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN 溶液,若溶液变红色,则证明生成了Fe3+,从而说明了FeCl2与 Cl2发生了氧化还原反应
③Cl2 +2Na2 CO3+ H2O=NaCl+ NaClO+2NaHCO3
④在丙装置后连接一个盛有NaOH溶液的洗气瓶(合理即可)
(2)加入碳酸钙粉末充分反应至溶液无色; 取步骤二中的上层清液于另一试管中,加入3滴品红溶液,振荡; 品红溶液褪色;氯水与碳酸钙反应后生成氯化钙溶液(实质是氯水中的HCl与CaCO3反应,而HClO不与CaCO3反应),为证明品红溶液褪色是次氯酸的作用,须设计实验证明氯化钙溶液不具有漂白性(或“排除氯化钙溶液的干扰”)
