A、B、C、D四种常见粒子分别是由x、y、z三种元素中的两种构成,已知x、y、z均为短周期元素,且原子半径依次减小;A、B、C、D均含有相同数目的电子,其中A含有5个原子核,它们之间有如右图的转化关系:
(1)x原子的基态电子排布式______,x、y两元素的第一电离能大小关系为x______y(填><或=)
(2)A的结构式为______.
(3)热稳定性大小比较为C______D(填><或=)
(4)B、C、D三种粒子结合质子能力由强到弱的顺序为______,试用2个离子方程式说明你的判断理由______、______.
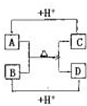
A、B、C、D均含有相同数目的电子,C与氢离子反应生成A,A含有5个原子核,则A为NH4+,C为NH3;B与NH4+反应生成NH3,所以B为OH-,D为H2O.由于x、y、z原子序数依次减小,所以x为N元素、y为O元素、z为H元素.
(1)x为N元素,原子核外有7个电子,基态电子排布式为1s22s22p3;y为O元素,N元素原子p能级有3个电子,为半满稳定状态,能量降低,第一电离能大于同周期相邻元素的第一电离能,所以x、y两元素的第一电离能大小关系为x>y,
故答案为:1s22s22p3;>;
(2)A为NH4+,结构式为
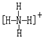
,故答案为:
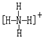
;
(3)C为NH3,D为H2O,非金属性越强,氢化物的稳定性越强,非金属性O>N,所以稳定性H2O>NH3,即热稳定性大小为C<D,故答案为:<;
(4)B为OH-,C为NH3,D为H2O.由于OH-+NH4+=NH3↑+H2O,NH3+H3O+=NH4++H2O,所以B、C、D三种粒子结合质子能力由强到弱的顺序为OH->NH3>H2O,
故答案为:OH->NH3>H2O;OH-+NH4+=NH3↑+H2O;NH3+H3O+=NH4++H2O.
