A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(1)写出下列各元素的名称:A______ D______
(2)上述五种元素中,第一电离能最小的元素是______,基态原子未成对电子数最多的原子核外电子排布式为______.
(3)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g)△H1=+49.0kJ/mol,BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g)△H2=-192.9kJ/mol,试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号书写);______
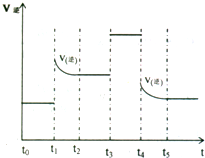
(4)对可逆反应3A2(g)+C2(g)⇌2CA3(g)当反应达到平衡位置时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是______.在一定温度下,若将4amol A2和2a mol C2放入lL的密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为______.若此时再向该容器中投入a mol A2,a mol C2利2a mol CA3,判断平衡移动方向______(“正”“逆”或“不移动”).
A原子半径最小,则A为H元素;B元素原子的最外层电子数是内层电子数的2倍,则B为C元素;C元素原子的电子层数为n,最外层电子数为2n+1,当n为2时,C为N元素,当n为3时,C为Cl元素,根据题意C不能为Cl,否则E就不是短周期元素,所以C为N元素;A、E同主族,所以E为Na元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,则D为O元素.
(1)由以上推断可知A为H元素,D为O元素,按要求写元素名称为:氢 氧,故答案为:氢 氧;
(2)根据第一电离能变化规律,周期表中,同周期从左到右,电离能逐渐增大,同主族从上到下,第一电离能逐渐减小,所以这五种元素中钠的第一电离能最小.
H、C、N、O、Na这五种元素的未成对电子依次为:1、2、3、2、1,N元素的未成对电子数最多,电子排布式为:1s22s22p3.故答案为:Na 1s22s22p3;
(3)把字母换成具体元素得:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-11 2
根据盖斯定律将②×3-①×2可得:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)3 2
△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-676.7kJ/mol;3 2
(4)从图象可看出,改变条件平衡一直向逆反应方向移动,故t0-t1 NH3含量最高.
3H2+N2=2NH3
起始浓度(mol/L) 4 a 2a 0
转化浓度(mol/L) 3a a 2a
平衡浓度(mol/L) a a 2a
K=
=(2a)2 a×a3
.若此时再向该容器中投入a mol A2,a mol C2和2a mol CA3时,4 a2
相当于加压,平衡向体积减少方向即正向移动.故答案为:t0-t1
正.4 a2
