根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:______.
(2)写出3p轨道上有2个未成对电子的元素的符号:______.
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是______.
(4)根据VSEPR模型,H3O+的分子立体结构为:______,SO2的立体结构为:______.
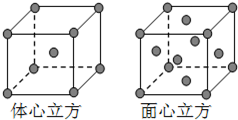
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为______;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为______.
(1)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为:
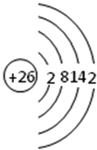
,故答案为:

;
(2)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,故答案为:Si或S;
(3)原子的外围电子排布是4s24p4,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,故答案为:硒;
(4)根据VSEPR模型得,H3O+的价层电子对=3+
(6-1-3×1)=4,有1个孤电子对,所以是三角锥形;SO2的价层电子对=2+1 2
(6-2×2)=3,有1个孤电子对,所以是V形,1 2
故答案为:三角锥形;V形;
(5)体心立方晶胞中铁原子个数=1+8×
=2;面心立方晶胞中实际含有的Fe原子个数=6×1 8
+8×1 6
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;1 8
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x=
;2
A3 3
铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=
A,其晶胞体积=22
A3.2
体心立方的密度与面心立方的密度之比=
:2m (
)32
A3 3
=34m 2
A32
:8,故答案为:1:2; 36
:8.6
