尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
(1)基态Fe3+的核外电子排布式为______.C、N、O三种元素的第一电离能由大到小的顺序是______.
(2)尿素分子中C、N原子的杂化方式分别是______.
(3)[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是______.与NO3-互为等电子体的一种化合物是______(写化学式).
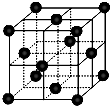
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①1个CO2分子周围等距离且距离最近的CO2分子有______个.
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是______.
(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,
同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:1s22s22p63s23p63d5;N>O>C;
(2)由尿素分子的结构式
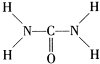
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3;
(3)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,H2NCONH2与Fe(Ⅲ)之间形成配位键,
N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体,
故答案为:配位键;SO3等;
(4)①以顶点的二氧化碳分子研究,与之最近的二氧化碳分子位于面心上,将晶胞补全可知,有3层每各有4个二氧化碳分子与之最近,故之最近的二氧化碳分子有4×3=12,
故答案为:12;
②若顶点为Au、面心为Cu,晶胞中含有Au原子数目为8×
=1,晶胞中含有Cu原子数目为6×1 8
=3,则铜金合金晶体中Au与Cu原子数之比为1:3,1 2
故答案为:1:3.
