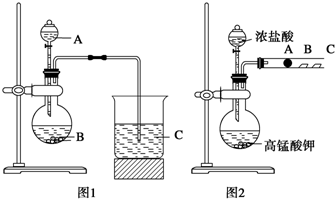
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)______;
①稀硫酸溶液; ②浓盐酸; ③石灰石;④碳酸钠粉末;⑤Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式______;
(2)甲同学所做实验图1烧杯中现象为______;
(3)乙同学所做实验图2中B处的现象为______;
(4)写出图2中A处发生反应的离子方程式:______.
(1)①验证元素非金属性与对应最高价含氧酸之间的关系,圆底烧瓶内的固体药品应为大理石,不能用碳酸钠粉末,反应剧烈,不易控制反应,所选取的酸应为稀硝酸,不能选硫酸,硫酸钙微溶,阻止碳酸钙与硫酸进一步反应.
所以烧瓶中应是碳酸钙与稀硝酸反应,因为碳酸钙难溶于水,要写分子式,硝酸是强酸,要写成离子,因此烧瓶中反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
故答案为:①、④;CaCO3+2H+=Ca2++CO2↑+H2O
(2)C中应盛装硅酸钠溶液,以此来证明硝酸、碳酸以及硅酸的酸性强弱,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,因此烧杯中反应的离子方程式是CO2+SiO32-+H2O=H2SiO3↓+CO32-,H2SiO3是白色沉淀.
故答案为:出现白色沉淀
(3)单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,氯气与KI反应Cl2+2KI═2Cl-+I2,生成碘单质,碘遇淀粉变蓝色.
故答案为:湿润的淀粉KI试纸变蓝
(4)单质的氧化性Cl2>Br2>I2,A处氯气通过沾有NaBr溶液的棉花溴化钠溶液,发生置换反应生成溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-
