氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如:
Na2O+Cl2═2NaCl+O2CaO+Cl2═CaCl2+O2
SiO2+2CCl4═SiCl4+2COCl2Cr2O3+3CCl4═2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式______;
(2)CCl4分子中C原子采取______杂化成键.
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键.光气分子的结构式是______,其中碳氧原子之间共
价键是______(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
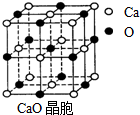
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______.CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1.导致两者晶格能差异的主要原因是______.
(1)Cr元素是24号元素,Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,故Cr3+的基态电子排布式为1s22s22p63s23p63d3,故答案为:1s22s22p63s23p63d3;
(2)CCl4分子中C原子成4个C-Cl单键,杂化轨道数目为4,采取sp3杂化,故答案为:sp3;
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,光气分子的结构式是

,C=O双键中含有1个σ键、1个π键,故答案为:

,c;
(4)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-,导致两者晶格能差异的主要原因是CaO晶体中离子的电荷数大于NaCl晶体中离子的电荷,故答案为:6,CaO晶体中离子的电荷数大于NaCl晶体中离子的电荷.
