[化学-物质结构与性质]
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:
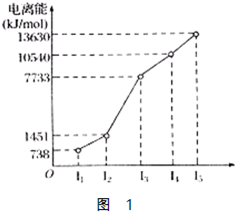
(1)X原子的电子排布式为______.
(2)电负性:X______Y(填“>”、“=”或“<”).
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料.有关Z2H4分子的说法正确的是______(填字母).
A、分子中含有氢键
B、和O2 分子具有相同的电子数
C、含有4个σ键和1个π键
D.Z的原子与氢原子形成的化学键可以旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图2所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).
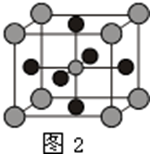
该晶体中,钛离子和周围______(填数字)个氧离子相紧邻.
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是______(填字母).
A.离子键 B.非极性键 C.配位键 D.金属键.
由信息可知:X、Y、Z三种元素分别为:钙、镁、碳,
(1)钙原子的电子排布式为:1s22s22p63s23p64s2,故答案为:1s22s22p63s23p64s2;
(2)因同一主族从上到下元素的电负性呈减小的趋势,而钙、镁在同一主族,钙在镁的下一周期,所以钙的电负性小于镁,故答案为:<;
(3)A、因C原子不能形成氢键,所以分子中没有氢键,故A错误;
B、C2H4的电子数为:16,O2 分子中电子数为16,故B正确;
C、C2H4的结构简式为CH2=CH2,一个单键就是一个σ键,一个双键是一个σ键和一个π键,所以分子中有5个σ键和1个π键,故C错误;
D.因C-H键可以旋转,故D正确;
故选:BD.
(4)取任何一个顶角的Ti原子,分别在X、Y、Z三个平面内找出最近的氧离子,在每个平面上有4个氧离子,共12个氧离子,故答案为:12;
(5)因NH4Cl的电子式为:
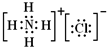
,铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在极性共价键和配位键,故选:BD.
