目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于______晶体;基态Ni原子的电子排布式为______.
(2)配合物
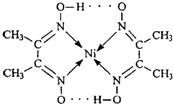
分子内的作用力有______(填编号).
A.氢键 B.离子键 C.共价键 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2、②CH≡CH、③
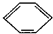
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
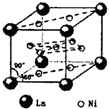
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点.该晶体的化学式______.
(1)配合物Ni(CO)4常温为液态,熔点低,易溶于CCl4、苯等有机溶剂,所以Ni(CO)4属于分子晶体.
Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2.
故答案为:分子晶体;1s22s22p63s23p63d84s2.
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
故选:ACE.
(3)①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化.
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化.
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①、③、④;平面三角形.
(4)该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为1+8×
=5,晶胞实际含有的镧原子为8×1 2
=1,所以晶体的化学式Ni5La.1 8
故答案为:Ni5La.
