(5分)(2012•深圳)小明为了测定铜和氧化铜混合物中氧化铜的质量分数.设计组装了如图的实验装置
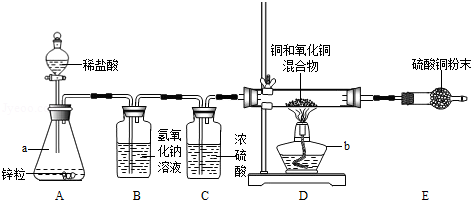
看图回答下列问题:
(1)仪器识别:a _________ ;b _________ .
(2)装置A中发生反应的化学方程式 _________ .
(3)能除去H2中混有少量HCl气体的装置是 _________ (填装置序号).
(4)装置E中硫酸铜粉末变蓝色,说明硬质试管中反应后有 _________ 生成.
(5)实验前硬质试管中混合物的质量为5g,实验后剩余固体质量为4.2g,求混合物中氧化铜的质量分数 _________ %.
(1)锥形瓶;酒精灯;(2)Zn+2HCl=ZnCl2+H2↑;(3)B;(4)水(或水蒸气或H2O);(5)80
(1)依据对常见仪器的认识可知a是锥形瓶b是酒精灯;
(2)A中发生的是锌与稀盐酸生成氯化锌和氢气的反应,其方程式为:Zn+2HCl=ZnCl2+H2↑;
(3)氯化氢气体溶于水形成盐酸,盐酸能和氢氧化钠发生中和反应,所以能除去H2中混有少量HCl气体的装置是B;
(4)硫酸铜粉末遇水会与水反应生成蓝色的硫酸铜晶体,所以装置E中硫酸铜粉末变蓝色,说明硬质试管中反应后有水生成;
(5)氢气还原氧化铜会生成水与铜,所以固体减小的质量是氧化铜中氧元素的质量,为5g﹣4.2g=0.8g.
所以氧化铜的质量是: =4g,则
=4g,则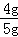 ×100%=80%;
×100%=80%;
