本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
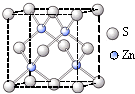
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol•L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
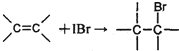
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
A.(1)①K3[Fe(CN)6为离子化合物,应含有离子键,Fe和CN之间为配位键,C与N之间为极性键,
故答案为:CEF;
②Fe的电子排布式为[Ar]3d64S2,则Fe3+离子的电子排布式为:[Ar]3d5,故答案为:[Ar]3d5;
③CN-为双原子离子,含有14个电子,其等电子体有CO、N2,故答案为:CO、N2;
④二氧化硒分子中含有2δ键个,孤电子对数为
=1,分子为V形,故答案为:V形;6-2×2 2
(2)As的价电子排布为4s24p3,而Se的价电子排布为4s24p4,二者相比较,前者p轨道半充满,处于稳定状态,第一电离能较大,硫化锌是离子化合物,硫元素与锌元素的物质的量比是1:1,每个硫原子与4个锌原子形成离子键,同时每个锌原子同时与4个硫原子形成离子键,故配位数为4,故答案为:>;4;
B.(1)卤素互化物IBr的性质与卤素单质类似,具有氧化性,腐蚀橡胶管,不能用碱式滴定管盛装,IBr易发生水解反应,反应方程式为:IBr+H2O=HIO+HBr,故答案为:酸式滴定管(或移液管 );IBr+H2O=HIO+HBr;
(2)溴化氢易挥发,置于暗处可减少溴化氢挥发,为使反应充分进行,应不断搅动使物质充分接触而反应,
故答案为:碘瓶置于暗处可减少溴化氢挥发,不断搅动可以让物质间充分反应;
(3)碘遇淀粉变蓝色,可用淀粉为反应的指示剂,滴定时终点的判断为 溶液由蓝色恰好变为无色且30秒内不变化,
故答案为:淀粉溶液;溶液由蓝色恰好变为无色且30秒内不变化.

 CaO+2HBr
CaO+2HBr 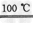 HgBr2+H2↑
HgBr2+H2↑  ___+___
___+___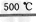 2Hg+O2↑
2Hg+O2↑  CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。