如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
试回答:
(1)A中发生的化学反应方程式为______.
(2)C、D、G中各装的药品:C______;D______;G______.
(3)E中的现象为______;反应方程式为______.
(4)写出G中反应的离子方程式______.
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因______.
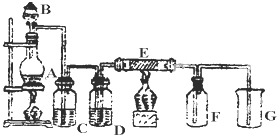
(1)A中是实验室制氯气的发生装置,发生的化学反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O, △ .
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; △ .
(2)实验制备氯气中含杂质气体氯化氢和水蒸气,通入E装置时需要除去杂质,所以通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;氯气有毒不能排到大气中,要进行尾气吸收,故答案为:饱和NaCl溶液;浓H2SO4 ;NaOH溶液;
(3)氯气和铁反应生成氯化铁产生棕褐色烟,剧烈反应放热,该反应为2Fe+3Cl2
2FeCl3 , 点燃 .
故答案为:剧烈反应,产生棕黑色(棕褐色)的烟,放出大量热;2Fe+3Cl2
2FeCl3 ; 点燃 .
(4)G中反应是尾气吸收装置,氯气有毒需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,氯气具有氧化性,二氧化硫具有还原性,二者1:1发生氧化还原反应生成硫酸和盐酸,反应的化学方程式为:Cl2+SO 2+2H2O═H2SO4+2HCl,故答案为:Cl2+SO 2+2H2O═H2SO4+2HCl.
