图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
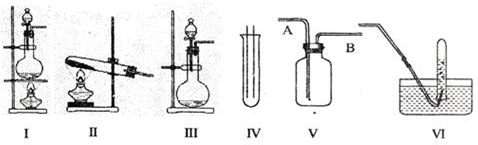
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置______,用方程式表示的制取氯气的反应原理是______.
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置______,试完成并配平下列离子方程式:______MnO4-+______C1-+______H+-______Mn2++______C12↑+______.
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用______溶液浸湿,其作用是______.
(4)若选用V为氯气收集装置,则氯气应从______口通入.用化学方法检验氯气收集满了的方法是______.
(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,
MnO2+4HC1(浓)
MnC12+C12↑+2H2O,故答案为:Ⅰ;MnO2+4HC1(浓) △ .
MnC12+C12↑+2H2O; △ .
(2)KMnO4与浓盐酸的反应是固液混合不需要加热的,所以应选择Ⅲ装置;MnO4-中锰元素的化合价是+7价,Mn2+的化合价是+2价,所以一个MnO4-生成Mn2+得5个电子,生成一个C12分子需要2个氯离子失去2个电子,所以得失电子的最小公倍数是10,再根据元素守恒知,生成物中还有水;所以该离子方程式中的计量数分别为:2、10、16、2、5、8,
故答案为:Ⅲ;2;10;16;2;5;8H2O;
(3)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:氢氧化钠;防止氯气逸出污染空气;
(4)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气.
故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满.
