(物质结构)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.请根据上表回答下列问题:

(1)G元素基态原子的电子排布式为______,其气态氢化物易液化,其原因是______.
(2)XR2中,X原子的轨道杂化类型为______,化合物ER2的熔点较XR2低,其原因是______.
(3)E、G、R三种元素的第一电离能由大到小的顺序是______(用元素符号填空).
(4)由A、E、G、R四种元素所形成的微粒中互为等电子体的有多组,请写出其中两组的化学式______.
(5)单质Z的晶体在1183K以下时为体心立方堆积,在1183K以上时为面心立方堆积,其晶胞结构如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Z原子的个数之比为______.Z3+比Z2+更稳定一些,其原因可能是______.
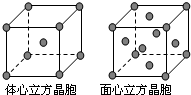
由元素在周期表中的位置可知,A为H,E为C,G为N,R为O,X为Si,Z为Fe,
(1)N的质子数为7,其电子排布式为1s22s22p3,因氨分子之间有氢键,则沸点高,易液化,故答案为:1s22s22p3;氨分子之间有氢键;
(2)SiO2中Si能形成4个Si-O键,则Si原子采取sp3杂化,又CO2属于分子晶体,SiO2属于原子晶体,则SiO2的熔点高,
故答案为:sp3;CO2属于分子晶体,SiO2属于原子晶体;
(3)非金属性越强,C的非金属性最弱,则C的第一电离能越大,但N原子的p轨道半满更稳定,失电子较难,则N的第一电离能最大,则
第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(4)因CH4和NH4+、NH3和H3O+、CO2和N2O、CO和N2中原子数目相同、价电子数相同,则它们属于等电子体,故答案为:CH4和NH4+、NH3和H3O+;
(5)体心立方晶胞中Fe原子在顶点和体心,则原子个数为1+8×
=2,面心立方晶胞中Fe原子在顶点和面心,原子个数为8×1 8
+6×1 8
=4,1 2
则实际含有的Z原子的个数之比为2:4=1:2;又因Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态,则Fe3+比Fe2+更稳定一些,
故答案为:1:2;Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
