已知Cl2和碱溶液在不同条件下,得到的产物不同.某兴趣小组用图甲装置制取氯酸钾、次氯酸钠和探究氯水的性质.(3Cl2+6KOH
KClO3+5KCl+3H2O)加热 . 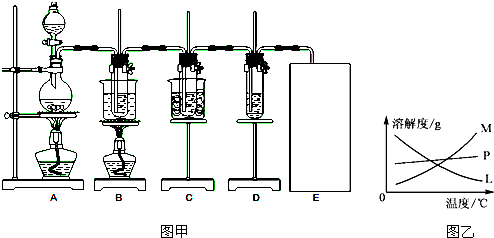
图甲中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过______(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式为______.需要向烧瓶中加碎瓷片吗?______(选填:“需要”、“不需要”).
(2)反应结束后,烧瓶里的溶液______.
A.一定显酸性B.可能显酸性,也可能为中性C.只有氧化性
D.只有还原性E.既有氧化性又有还原性
(3)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出.图乙中符合该晶体溶解度曲线的是______(填编号字母);从B的试管中分离出该晶体必须用到的玻璃仪器有______.
(4)该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有HCl气体.对此问题可以通过改进实验装置的方法进行避免.方法是______.
(5)实验中可观察到D的试管里溶液的颜色由紫色先变为______色,最终变为______色.
(6)C装置中反应完毕的现象是______.
(7)请在装置图甲方框中画出缺少的实验装置,并注明试剂.
(1)制备氯气的原理是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,浓盐酸从分液漏斗中加入,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,反应物是固体和液体加热反应不需要加入碎瓷片;△ .
故答案为:分液漏斗,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,不需要;△ .
(2)A为氯气发生装置,二氧化锰 和浓盐酸加热反应随反应进行浓盐酸变化为稀盐酸不再和二氧化锰反应生成氯气,所以烧瓶中一定是强酸溶液盐酸,既具有氧化性如H+的氧化性,又具有还原性,Cl-具有还原性;
故答案为:AE;
(3)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,反应完毕经冷却后,B的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,需要的玻璃仪器为:漏斗、玻璃棒、烧杯;
故答案为:M;过滤;HCl;AB间增加一个洗气装置;
(4)氯气中可能含有氯化氢气体,AB间增加一个洗气装置,盛饱和食盐水的洗气瓶吸收氯化氢,避免产生误差;
故答案为:在A、B装置之间加一个盛饱和食盐水的试管或洗气瓶;
(5)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,二者在水中溶解且电离,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O,氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色;
故答案为:红;无;
(6)分析装置C中试管里盛有15mL 8% NaOH溶液,并置于冰水浴中,氯气与稀NaOH溶液反应生成次氯酸钠,反应完后氯气会在试管呈黄绿色
故答案为:C中试管上部空间充满黄绿色气体;
(7)烧杯中液体试剂为强碱溶液,导管要通入液面至少1/3,太浅不可以,是一个敞口体系,剩余的氯气不能排放到空气中,需要用氢氧化钠溶液吸收,装置图为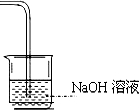 ;
;
故答案为: .
.
