化学-物质结构
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
请回答下列问题:
(1)写出铬原子的基态电子排布式______,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为______,配位数为______.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______(填“极性”或“非极性”)分子.
(3)在①苯 ②CH3OH ③HCHO ④CS2⑤CCl4⑥CH3Cl ⑦HCOOH七种有机物质中,碳原子采取sp2杂化的分子有______(填序号),CS2分子的空间构型是______.
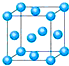
(1)Cr的原子序数为24,根据能量最低原理可知基态原子的电子排布式为1s22s22p63s23p63d54s1,
铬原子的最外层电子数为1,位于第四周期,
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu,
晶胞中原子分布于顶点和面心,则原子的数目为:8×
+6×1 8
=4,1 2
与顶点金属原子距离最近的原子位于面心位置,则配位数为8×
=12,3 2
故答案为:1s22s22p63s23p63d54s1; K、Cu;4;12;
(2)CCl4、CS2等为非极性分子,CrO2Cl2能与CCl4、CS2等互溶,根据相似相溶可知,CrO2Cl2为非极性分子,
故答案为:非极性;
(3)①苯中C形成3个δ键,为sp2杂化,②CH3OH中C形成4个δ键,为sp3杂化,
③HCHO中C形成3个δ键,为sp2杂化,④CS2中C形成2个δ键,为sp杂化,
⑤CCl4中C形成4个δ键,为sp3杂化,⑥CH3Cl中C形成4个δ键,为sp3杂化
⑦HCOOH中C形成3个δ键,为sp2杂化,
所以碳原子采取sp2杂化的分子有①③⑦,
CS2分子中C形成2个δ键,孤电子对数为
=0,价层电子对为2,所以CS2分子为直线形.4-2×2 2
故答案为:①③⑦; 直线形.
