不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.
(1)写出Fe2+的基态离子的电子排布式:______;基态碳(C)原子的电子排布图为______
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr的配位数为______;已知CrO5中Cr为+6价,则CrO5的结构式为______.
(3)H2O的分子构型为______;H2O分子间能形成氢键的原因是______.
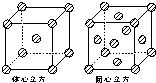
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为______.
(1)Fe的原子序数为26,Fe的基态原子的电子排布式为1s22s22p43s23p43d64s2,则Fe2+的基态离子的电子排布式为[Ar]3d6或1s22s22p43s23p43d6,C原子序数为6,则基态碳(C)原子的轨道表示式为
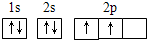
,
故答案为:[Ar]3d6或1s22s22p43s23p43d6;

;
(2)[Cr(H2O)4Cl2]Cl•2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
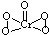
,故答案为:6;
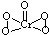
;
(3)H2O中含有2个δ键,2个孤电子对,则分子的立体构型为V形,O原子电负性较大,氢化物中含有氢键,
故答案为:V形分子;分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子;
(4)图中体心立方晶胞Fe原子位于顶点和体心,晶胞中含有1+8×
=2个Fe原子,1 8
面心立方晶胞中Fe原子位于顶点和面心,晶胞中含有6×
+8×1 2
=4个Fe原子,1 8
所以两种晶体的基本结构单元中的原子个数之比为2:4=1:2,
故答案为:1:2.
