[化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 | A | B | C | D |
| 结构性质 信息 | 基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点______(填“高”或“低”).
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是______(填序号).a.离子键 b.极性键c.非极性键d.配位键 e.金属键
(5)下列分子结构图中的“

”表示上述相关元素的原子中除去最外层电子的剩余部分,“

”表示氢原子,小黑点“

”表示没有形成共价键的最外层电子,短线表示共价键.
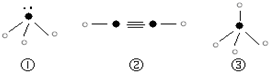
则在以上分子中,中心原子采用sp3杂化形成化学键的是______(填序号);在②的分子中有______个σ键和______个π键.
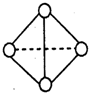
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=______KJ/mol.
A的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则电子排布式为:1s22s22p2,故A为C,B原子核外有两个电子层,最外层有3个未成对的电子,则电子排布式为:1s22s22p3,故B为N,C的基态原子的M层有2对成对的p电子,故电子排布式为:1s22s22p63s23p4,故C为S,D的原子序数比A、B、C三种元素原子的质子数总和还少1,即为29,故D为Cu,
(1)铜原子的基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故外围电子排布式为:3d104s1,在四种原子中,只有铜原子最外层电子数为1,第一电离能最小,
故答案为:3d104s1;Cu;
(2)氨气分子之间存在氢键,沸点较高,比同主族相邻元素氢化物PH3的沸点高,故答案为:高;
(3)从图中所给的数据可以看出:C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子,故答案为:C=O的键能比C-O的键能的两倍要大,Si=O的键能比Si-O的键能的两倍要小,所以Si和O成单键更稳定,而C和O以双键形成稳定分子;
(4)[Cu(NH3)4]SO4中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合,氮原子和氢原子、氧原子和硫原子之间为极性共价键,故答案为:ac;
(5)①为氨气②为乙炔③为甲烷,其中氨气和甲烷的中心原子均以sp3杂化形成化学键,在乙炔中,含有一个碳碳三键(其中一个为σ键,另两个为π键)和两个碳氢单键(均为σ键),故答案为:①③; 3; 2;
(6)1molN4分子中含有6mol的N-N键,断裂这些化学键要吸收6aKJ的能量,生成2molB≡B放出2bKJ热量,故△H=-(2b-6a),故答案为:-(2b-6a).
