问题
填空题
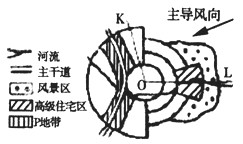
常温下,浓度均为0.1 mol·L-1的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是__________(填编号,下同), 溶液中溶质存在电离平衡的是
____________________;
(2)比较①、②溶液,PH值较大的是____________________;
(3)在溶液④中加入少量NH4Cl固体,此时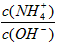 的值将_________(填“变小”,“变大”或“不变”);
的值将_________(填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如图所示

①试分析在滴定过程中,滴定曲线上a、b、c、d四点: 水的电离程度最大的是___________点;
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是________________________。
答案
(1)①②;②④
(2)①
(3)变大
(4)①d;②c(Cl-)>c(NH4+)>c(Na+)