问题
计算题
在室温时有50ml的混合气体,它们可能由HCl、NH3、CO2、NO组成。将这些混合气体通过浓H2SO4后体积减少为35ml ,再通过过量的过氧化钠气体体积又减少为20ml,最后将气体通过水,充分反应后只剩下10ml 气体。(所有气体体积在同温同压下测定)求:
① 混合气体由哪些气体组成?它们的各占多少毫升?
② 最后剩余气体是什么气体?
答案
①混合气体由29mlCO2,15mlNH3,6mlNO组成。②剩余气体为O2,其体积为10ml.
50ml混合气体通过浓H2SO4体积减少为35ml,则NH3体积为50ml-35ml=15ml。由此确定无HCl。由题意可知还有CO2和NO。设含CO2为xml,NO为yml,若最后10ml为NO,则由:3NO2+H2O=2HNO3+NO可知需NO2为30ml>20ml,不合题意,若最后10ml为O2,则由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗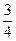 ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为
ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2为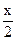 ml,
ml,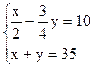 解得
解得 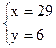
则NH3为15ml,CO2为29ml,NO为6ml
