
已知:
 4NO+3O2+2H2O 4HNO3
4NO+3O2+2H2O 4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80,请完成下列填空及计算:
(1)a mol NO完全转化为HNO3需要氧气 mol。
(2)为使NH3恰好完全氧化为一氧化氮,氨与空气混合物中氨的体积分数为 (保留2位小数)。
(3)20.0 mol的NH3用空气氧化,产生混合物的组成为NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其他成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4)20.0 mol的NH3和一定量空气充分反应后,再转化为HNO3。
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
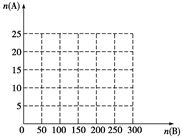
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式 。
(1)0.75a (2)0.14 (3)97.5%
(4)①

②n(A)=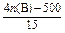
(3)设生成HNO3的物质的量为x。则
4(2x+18.0 mol×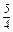 +12.0 mol)="150.0" mol
+12.0 mol)="150.0" mol
解得x="1.5" mol
NH3的转化率=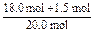 ×100%=97.5%
×100%=97.5%
