问题
计算题
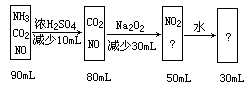
有90mL无色混合气体,其中可能有NH3,HCl,CO2,NO,把混合气体通过浓硫酸,气体的体积减少了10mL,再通过过氧化钠固体,气体体积又减少了30mL,气体变为红棕色,又通过水后,剩余气体体积为30mL(实验是在同温同压下进行,不计水蒸气体积)。试回答:
(1)该混合气体由哪些气体混合而成?各占多少mL?
(2)最后剩余30mL是什么气体?简要说明理由。
答案
(1)NH3——10mL,CO2——30mL,NO——50mL;
(2)剩余的30mL为NO。
(1)气体通过浓H2SO4减少10mL,说明含10mLNH3,一定不含HCl,气体变为红棕色说明有CO2和NO。
(2)可用下图分析此题:
2Na2O2+2CO2=2Na2CO3+O2↑
+) O2+2NO=2NO2
___________________________
2Na2O2+2NO+2CO2=2NO2+2Na2CO3
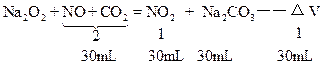
所以:①80mL气体中含:CO2 30mL,NO50mL;②50mL气体中含:NO230mL,NO 20mL。
由3NO2+H2O====2HNO3+NO
3 1
30Ml 10mL
所以最后30mL气体为NO:(10+20)=30mL。
