现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)用______(填仪器名称)量取10.00mL食用白醋,在______(填仪器名称)中用水稀释后转移到100mL______(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴______作指示剂.
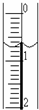
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______mL.
(4)滴定.当______时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积 V=
mL=15.24mL.15.95+15.00+15.05+14.95 4
指出他的计算的不合理之处:______.
按正确数据处理,可得c(市售白醋)=______mol/L;市售白醋总酸量=______g/100mL.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号).
a.pH b.电离度 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
I.(1)用滴定管(或10mL移液管)(量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL 容量瓶中定容,摇匀即得待测白醋溶液,故答案为:滴定管(或10mL移液管);烧杯; 容量瓶;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,故答案为:酚酞;(3)滴定管液面的读数0.60mL,故答案为:0.60;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色,
故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
III.(1)第1次滴定误差明显大,属异常值,应舍去;3次消耗的NaOH溶液的体积为:15.00mL;15.05mL;14.95mL;则NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOOH Xg,则
CH3COOOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
c(市售白醋)=
=0.75mol/L,样品总酸量4.50g/100mL,0.450g 60 g/mol 0.01L
故答案为:第1次滴定误差明显大,属异常值,应舍去; 0.75; 4.5;
(2)电离常数判断酸的强弱,依据电离常数的大小判断酸性强弱,进而判断反应能否发生,其他选项不能判断酸的强弱,故选:c;
(3)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据C(待测)=
分析可知C(待测)偏大,故a正确;C(标准)×V(标准) V(待测)
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据C(待测)=
分析可知C(待测)偏大,故b正确;C(标准)×V(标准) V(待测)
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据C(待测)=
分析可知C(待测)不变,故c错误;C(标准)×V(标准) V(待测)
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据C(待测)=
分析可知C(待测)偏小,故d正确;C(标准)×V(标准) V(待测)
故选:ab
