N2O5是一种新型硝化剂,其性质和制备受到人们的关注。






(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2 O5可发生下列反应:
 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。
 |
(3)如上图所示装置可用于制备N2O5,则N2O5在电解池的
区生成,其电极反应式为 .
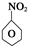 (1)
(1)
(2)①不变
②0.002 96 mol·L-1·s-1
③<或小于
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
(2)①因为恒容下充入N2,N2为非反应性气体,所以平衡不移动,因而N2O5的转化率不变。
②v(N2O5)=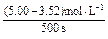
="0.002" 96 mol·L-1·s-1。
③T1温度下c (NO2)求算:
 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2 4
1 000 s时,5.00-2.48 c(NO2)
c(NO2)=2×(5.00-2.48) mol·L-1="5.04" mol·L-1>4.98 mol·L-1,由于反应是吸热反应,故温度越高NO2的浓度越大,所以得到T2<T1。
(3)由图中给定两极物质可以判断N2O5必是由N2O4氧化生成,所以N2O5在阳极产生。据电极反应离子放电顺序可知:阴极发生2H++2e-→H2↑的反应,则阳极为N2O4+2HNO3-2e-→2N2O5+2H+。
