某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,该氮的氧化物是
A.N2O
B.NO
C.NO2
D.N2O5
答案:B
从反应产物N2和CO2的系数之比为1∶2得出参加反应的氮的氧化物NOx和CO的系数之比为2∶2,即:2NOx+2CO→N2+2CO2,由氧原子守恒可知x=1,即NO。
某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,该氮的氧化物是
A.N2O
B.NO
C.NO2
D.N2O5
答案:B
从反应产物N2和CO2的系数之比为1∶2得出参加反应的氮的氧化物NOx和CO的系数之比为2∶2,即:2NOx+2CO→N2+2CO2,由氧原子守恒可知x=1,即NO。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)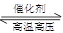 2NH3(g) △H=—92.4kJ/mol,
2NH3(g) △H=—92.4kJ/mol,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
试判断K1 K2(填写“>” “ =”或“<”)。
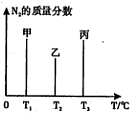
(2)用2mol N2和3mol H2合成氨,三容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是 ,都达到平衡状态时,N2转化率最低的是 。
(3)NH3与CO2在120oC,催化剂作用下可以合成反应生成尿素:CO2 +2NH3 (NH2)2CO +H2O
(NH2)2CO +H2O
在密闭反应容器中,混合气体中NH3的含量变化关系如图所示
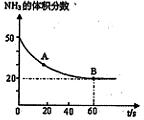
(该条件下尿素为固体)。则A点的正反应/速率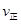 (CO2) B点的逆反应速率
(CO2) B点的逆反应速率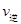 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(4)已知下列热化学方程式:
2H2(g)+O2(g)=2H2O(1) △H = -571.6kJ/mol
N2(g)+O2(g) 2NO(g) △H =+180kJ/mol
2NO(g) △H =+180kJ/mol
请写出用NH3还原NO的热化学方程式_ ;
(5)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____ 。科学家利用此原理,设计成氨气-氧气燃料电池,则通人氨气的电极是 (填“正极”或“负极”),在碱性条件下,通人氨气的电极发生的电极反应式为 。