问题
问答题
某同学用0.1082mol/L 的NaOH溶液滴定未知浓度的盐酸,以下是实验数据记录表.解答40-42小题:
| 实验序号 | 待测盐酸溶液的体积mL | 滴定管读数 | 消耗标准NaOH溶液的体积mL | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)列出求算待测盐酸溶液浓度的计算式(须含上表相关数据,不必计算结果)
(3)该同学欲测量一个玻璃容器的容积.他先量取20.00mL 3.820mol/L的H2SO4溶液注入该容器,加蒸馏水直至完全充满容器.待混合均匀后,从中取出25.00mL溶液置于锥形瓶中用0.1082mol/L 的NaOH溶液滴定,耗去碱液22.60mL.计算该玻璃容器的容积.
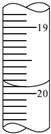
答案
(1)滴定管液面读书为:19.90mL,消耗标准NaOH溶液的体积为:19.90mL-0.05mL=19.85mL,
故答案为:19.90mL;19.85mL;
(2)c(待测)=
=c(标准)×V(标准) V(待测)
mol/L;0.1082×
×10-319.90+19.82 2 20.00×10 -3
故答案为:
mol/L0.1082×
×10-319.90+19.82 2 20.00×10 -3
(3)H2SO4 +2NaOH=Na2SO4 +2H2O
1 2
25.00mL×c 22.60mL×0.1082mol/L
c=0.04890mol/L
稀释前后溶质的物质的量不变:20.00mL×3.820mol/L=V×0.04890mol/L,V=1562.3mL=1.562L,故答案为:1.562L
