某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从______色变为______ 色时,停止滴定.
(2)该小组在步骤①中的错误是______,由此造成的测定结果______(偏高、偏低或无影响).
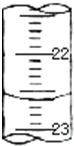
(3)如图,是某次滴定时的滴定管中的液面,其读数为______mL.
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,故答案为:红;
(2)锥形瓶装液前不能润洗;若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(酸)增大,根据c(碱)=
可知,c(碱)偏高,故答案为:锥形瓶不能用待测液润洗;偏高;c(酸)×V(酸) V(碱)
(3)滴定管中的液面的读数为22.60mL,故答案为:22.60;
(4)两次消耗的盐酸标准液的体积为24.90mL,25.10mL,均有效,盐酸溶液的平均体积为
=24.90mL+25.10mL 2
25.00mL,
HCl~NaOH
1 1
0.1000mol•L-1×25.00 c(烧碱)×20.00
解得c(盐酸)=0.1250mol/L,故答案为:0.1250;
