3.2 g Cu与过量硝酸(a mol·L-1,30 mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1 mol。
(1)此时溶液中所含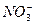 为_______________mol。
为_______________mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH====NaNO3+NaNO2+H2O,NO2+NO+2NaOH====2NaNO2+H2O。
若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
(1)0.2
(2)(0.045a-0.35) mol,(0.15-0.015a)mol
(3)8.3≤a<10
(1)利用溶液中电荷守恒:n(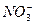 )×1=n(Cu2+)×2+n(H+)×1,所以,n(
)×1=n(Cu2+)×2+n(H+)×1,所以,n(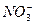 )="0.2" mol
)="0.2" mol
(2)设生成气体中NO2、NO的物质的量分别为X、Y。
由得失电子守恒:X+3Y="0.1" mol
由“N”元素守恒:X+Y="(0.03a-0.2)" mol
解得:X="(0.045a-0.35)" mol;Y="(0.15-0.015a)" mol 。
(3)根据题给信息,完全吸收的条件是n(NO2)≥n(NO)时,才可能被完全吸收。
所以,首先是要保证产生NO、NO2,则列式为①②式:
X>0得:a>7.8①
Y>0得:a<10②
再由必须完全吸收的条件列③式:
X≥Y得:a≥8.3③
所以,三式联立解不等式组,得到a的取值范围:8.3≤a<10。
