在25mL0.1mol•L-1的NaOH溶液中逐滴加入0.2mol•L-1的CH3COOH溶液,溶液pH变化曲线如图1所示.
(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?______(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在______(填“AB”、“BC”或“CD”)区间内.
(2)关于该滴定实验,从下列选项中选出最恰当的一项(选用滴定管如图2所示)______.
| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 甲基橙 | 甲 |
| C | 碱 | 酸 | 酚酞 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |
(4)在C点,溶液中离子浓度由大到小的顺序为:______.
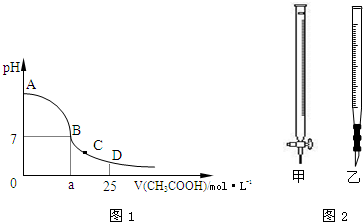
(1)NaOH溶液与CH3COOH溶液恰好完全反应时,生成了醋酸钠,醋酸根离子水解,溶液显示碱性,溶液的pH大于7;二者恰好完全反应时溶液的pH大于7,所以应该在AB段,
故答案为:否;AB;
(2)根据题干信息,锥形瓶中应该盛放氢氧化钠溶液,滴定管中盛放醋酸,二者恰好反应时溶液显示碱性,应该使用酚酞作为指示剂,所以C正确,
故选C;
(3)D点时醋酸的体积为25mL,n(CH3COO-)+n(CH3COOH)=0.2mol•L-1×0.025L=0.005mol,
n(Na+)=0.1mol•L-1×0.025L=0.0025mol,所以n(CH3COO-)+n(CH3COOH)=2n(Na+),
由于溶液的体积相同,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),
故答案为:=;
(4)在C点,溶液的pH<7,氢离子浓度大于氢氧根离子浓度,根据电荷守恒:CH3COO-+OH-=Na++H+可知,溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
