(9分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
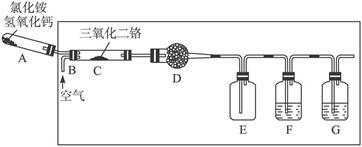
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是__________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是______________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是_________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。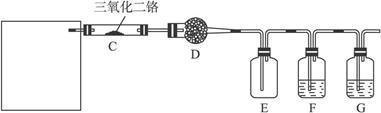
(1)C 若先加热A装置,则产生的氨气溶解在F中而得不到纯净的硝酸
(2)P2O5,除去C中未反应的氨气
(3)缓冲气流 防止倒吸 水、NaOH溶液
(4)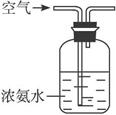
本题以工业生产为背景,实际考查NH3的催化氧化,在检验完装置的气密性后,应先加热C处,否则如果先加热A处,那么制得的NH3向后输送,使NH3溶解于F中,制得的硝酸不纯。在D中放入P2O5吸收NH3和水蒸气,在E、F通入的是纯净的硝酸气流。E装置是安全瓶的作用:缓冲气流,防止倒吸。由于硝酸溶解度较大,所以用水吸收即可。G是尾气的处理,用NaOH溶液吸收过量的硝酸气体。用空气气流携带NH3即可(见图所示)。
