某化学小组为测定加碘盐中KIO3的质量分数并制备少量KIO3,进行了如下实验.
I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O; I2+2Na2S2O3=2Na I+Na 2S4O6
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol•L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有______.
(2)步骤三中到达滴定终点时的现象为______.
(3)实验测得此加碘盐中KIO3的质量分数=______(KIO3的相对分子质量为214).
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.
该化学小组通过以下装置制备KIO3.
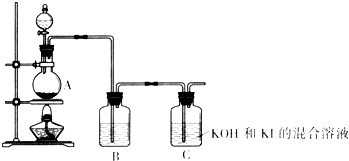
(4)装置A中反应的离子方程式为______.
(5)装置B中的试剂为______.
(6)写出装置C中生成KIO3的离子方程式______.
(7)上述实验装置存在一处明显缺陷,请指出______.
Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,
故答案为:250mL容量瓶;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,故答案为:溶液蓝色褪色;
(3)25mL溶液消耗Na2S2O3的物质的量为c mol•L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012cmol×10=0.12cmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1 6
xmol 0.12cmol
所以x=0.02c
故加碘盐中KIO3的质量分数
×100%=0.02cmol×214g/mol ag
%,428c a
故答案为:
%;428c a
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备,装置A的反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O, △ .
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O; △ .
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解,
故答案为:饱和食盐水;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水,反应离子方程式为3Cl2+I-+6OH-=6Cl-+IO3-+3H2O,故答案为:3Cl2+I-+6OH-=6Cl-+IO3-+3H2O;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气,故答案为:缺少吸收氯气的尾气吸收装置.
